膵がんmRNA血液検査(販売名:パンレグザ®)
臨床的意義
逆転写反応およびPCRによって合成された二本鎖DNAに結合する蛍光物質の蛍光強度を測定するリアルタイムPCR法を用い、全血より抽出したmRNA量に基づく膵癌の遺伝⼦発現パターンを検出するキットです。CA19-9測定値と組み合わせて判定することで膵癌の診断補助を目的として用います。
臨床性能試験成績
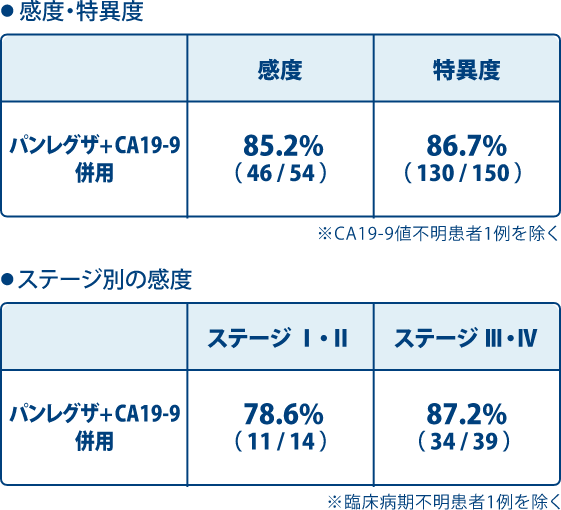
感度・特異度およびステージ別の感度*1
パンレグザとCA19-9の併用における膵癌(全ステージ)に対する感度および特異度は、それぞれ85.2%、86.7%でした。

 <試験概要>
<試験概要>
| 試験期間 |
2016.6.23-2017.6.30 |
|---|---|
| 試験デザイン |
非盲検試験 |
| 試験方法 |
膵癌、慢性膵炎、膵管内乳頭粘液性腫瘍とそれぞれ確定診断された患者および健常者(非癌症例)から血液を採取し、mRNA,CA19-9,CEAの各検査を実施した。 |
| 対象 |
膵癌患者54例、慢性膵炎患者22例、膵管内乳頭粘液性腫瘍患者25例、健常者103例 |
| 主要評価項目 |
mRNA検査における感度、特異度 |
新しい検査原理*2
臨床性能試験の結果から、パンレグザは腫瘍マーカーとは独立した膵癌バイオマーカーであることが右記表の通り示されました。

(対象:膵癌患者53例、慢性膵炎患者22例、膵管内乳頭粘液性腫瘍患者23例、健常者102例)
検査原理
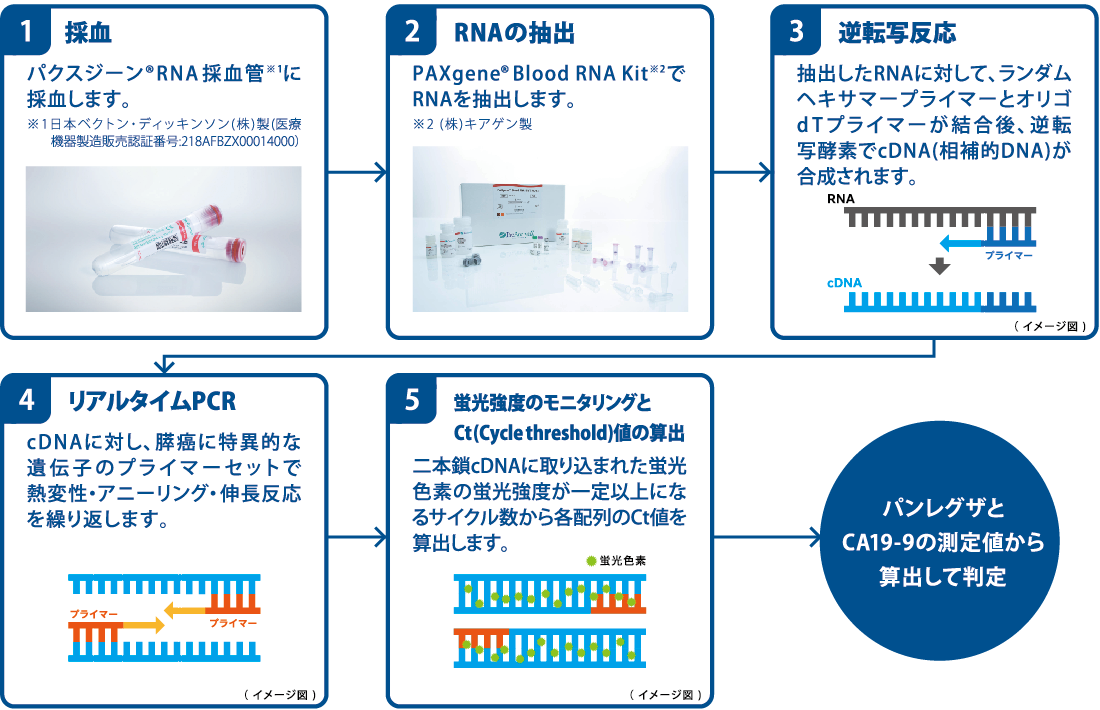
膵癌患者、非膵癌患者では末梢血液由来のmRNA発現プロファイルが異なることが報告されています*3。パンレグザは末梢血中のmRNA量の変化を捉え、膵癌に特異的な遺伝子発現パターンを検出するキットです。

測定の流れ
(株)キュービクス社内資料(承認時評価資料)
Sakai, Y. et al. Development of novel diagnostic system for pancreatic cancer, including early stages, measuring mRNA of whole blood cells:Cancer Science 2019 ; 110(4):1364 -1388.
Honda, M. et al. Differential gene expression profiling in blood from patients with digestive system cancers:Biochem Biophys Res Commun 2010 ; 400(1) : 7-15.
検査の委託について
本検査の委託については、お取引のある臨床検査会社にお問い合わせください。
製品情報

- 本品は類縁疾患でも陽性の結果となる場合があることから、本品の結果のみで膵癌の診断はできないことに留意すること。
- 早期膵癌の場合には、本品による検出ができない可能性があることに留意すること。
全般的な注意
- 本品は、体外診断用医薬品であり、それ以外の目的には使用しないでください。
- 本品は、CA19-9の結果と組み合わせて判定する体外診断用医薬品であり、単独では使用できないことに留意してください。
- 判定結果に基づく診断は、本キットの結果、及び他の関連する検査結果、臨床症状とあわせて、担当医師が総合的に判断してください。
- 添付文書に記載された使用目的及び用法・用量に従って、使用してください。記載された使用目的及び用法・用量以外での使用については、結果の信頼性を保証しかねます。
- 使用前に添付文書をよく読み、本品の各構成試薬及びその使用方法を理解してください。また、使用する機器の添付文書及び取扱説明書をよく読み、記載に従って使用してください。
操作上の注意(抜粋)
-
妨害物質・妨害薬剤
免疫抑制剤、副腎皮質ホルモン剤、抗悪性腫瘍剤を服用、または投与されている場合、正しい検査結果が得られないことがあります。 - 採血方法
パクスジーン®RNA採血管(日本ベクトン・ディッキンソン株式会社)の取扱説明書に従ってください。 - RNA 抽出
操作方法はPAXgene® Blood RNA Kit(株式会社キアゲン)の取扱説明書に従ってください。
使用目的
全血から抽出したmRNA量に基づく膵癌の遺伝子発現パターンの検出(膵癌の診断補助)
別途必要な機器・器具・試薬
-
採血管
パクスジーン®RNA 採血管(日本ベクトン・ディッキンソン株式会社 医療機器製造販売認証番号:218AFBZX00014000 ) -
RNA 抽出キット
PAXgene® Blood RNA Kit(株式会社キアゲン) -
リアルタイム PCR 装置
ロータージーン Q MDx 5plex HRM(株式会社キアゲン 医療機器製造販売届出番号:13B2X10223000004) - 遠心分離器
- ボルテックスミキサー
- サーマルサイクラー、ヒートブロックなどの温度調整装置
- 反応用チューブ(滅菌済み)
- PCR 用チューブ(滅菌済み)
- 試薬の混合及び反応液調製に用いるマイクロピペット、ピペットチップ(疎水性フィルター付き)
形状・構造等(キットの構成)
- DNase 20μL×1本
- Distilled Water 40μL×1本
- RT Buffer 40μL×1本
- Marker RNA 10μL×1本
- Reverse Transcriptase 20μL×1本
- Positive Control 10μL×1本
- 2×PCR Mix 488μL×10本
- プライマー57種 75μL(CFHR3は225μL)×各1本
包装単位
10 テスト用
貯蔵方法
-20℃以下で保管
有効期間
製造日から12カ月
詳細は、電子添文をご確認ください。PMDA(独立行政法人 医薬品医療機器総合機構)のウェブサイトで検索いただけます。
よくあるご質問
- Q.この検査を委託するにはどうすればよいですか?
臨床検査会社に委託可能です。お取引先にお問い合わせください。
- Q.この検査キットを購入すれば自院でも検査できますか?
可能です。必要な機器等につきましては、電子添文をご確認ください。PMDA(独立行政法人 医薬品医療機器総合機構)のウェブサイトで検索いただけます。
- Q.この検査は保険請求可能ですか?
不可です。保険適用外のため自費診療となります。
- Q.検査前の制限事項はありますか?
特にありません。但し、受診者が免疫抑制剤、副腎皮質ホルモン剤、抗悪性腫瘍剤を服用、または投与されている場合、正しい検査結果が得られないことがあります。
- Q.採血条件や保管方法を教えてください
日本ベクトン・ディッキンソン株式会社製のパクスジーンRNA採血管(医療機器認証番号:218AFBZX00014000)を使用します。また、同メーカーの採血ホルダーの使用とCA19-9の同時採血が必須ですので、ご注意ください。
パクスジーンRNA採血管は、採血後8~10回転倒混和して、2時間常温で静置してください。その後はCA19-9の検体と一緒に冷蔵保管してください。
詳しくはお取引のある臨床検査会社にお問い合わせください。- Q.感度や特異度について教えてください。
感度は85.2%、特異度は86.7%です。なお、非癌症例には健常人のほか、慢性膵炎患者とIPMN患者を含みます。
また、本検査はCA19-9の結果と組み合わせて判定する体外診断用医薬品であり、単独では使用できないことに留意してください。詳しくは電子添文をご確認ください。PMDA(独立行政法人 医薬品医療機器総合機構)のウェブサイトで検索いただけます。- Q.本検査で陽性と判定された場合、がんと診断できるのでしょうか?
判定結果に基づく診断は、本検査の結果、及び他の関連する検査結果、臨床症状とあわせて、担当医師が総合的に判断してください。詳しくは電子添文をご確認ください。PMDA(独立行政法人 医薬品医療機器総合機構)のウェブサイトで検索いただけます。
- Q.マイクロアレイ血液検査との違いは何ですか?
mRNAの発現パターンを測定する点は同じですが、マイクロアレイ血液検査はマイクロアレイ(DNAチップ)を、本検査はリアルタイムPCRを使用するため、測定デバイスが異なります。また、本検査は薬事承認を受けている点も異なります。
- Q.既存の腫瘍マーカーとの違いは何でしょうか?
本検査は既存の腫瘍マーカーとは異なり、膵癌の診断補助を目的とした新しい検査です。膵癌患者特有の全血中のmRNAの発現パターンを測定し、ステージにかかわらず高い感度を示します。


パンレグザ®は株式会社キュービクスの登録商標です。


